strsismos88
Νεοφερμένο μέλος


Εγω βγαζω α = 0,5 ενω στη λυση γραφει α = 1/3.
Σημείωση: Το μήνυμα αυτό γράφτηκε 15 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
lowbaper92
Πολύ δραστήριο μέλος


Εχω απορια στην εξης ασκηση: Σε ενα υδατικο διαλυμα ασθενους οξεος ΗΑ βρεθηκε οτι στην κατασταση ισορροπιας ισχυει [HA] = 2[A-]. Ζητειται το pH του διαλυματος και ο βαθμος ιοντισμου του ΗΑ. Δινεται για το ΗΑ: Ka = 0,05
Εγω βγαζω α = 0,5 ενω στη λυση γραφει α = 1/3.
Έχουμε:
Άρα
Σημείωση: Το μήνυμα αυτό γράφτηκε 15 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
strsismos88
Νεοφερμένο μέλος


Σημείωση: Το μήνυμα αυτό γράφτηκε 15 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.


γεια σασ 8α ηθελα να με βοηθησετε σε μια ασκηση και ειδικα στην αρχικη αντιδραση επειδη εχω κολλησει,λοιπον...αλκυλοχλωριδιο Α αντιδρα με υδατικο δ/μα Ag2O και σχηματιζει την οργανικη ενωση Β.το αλκυλοχλωριδιο Α αντιδρα επισης με το αλας Να ενος οξεος, οποτε σχηματιζεται αιθανικος ισοπροπυλεστερας. Να βρεθουν οι συντακτικοι τυποι των ενωσεων Α και Β....ευχαριστω πρωκαταλιβολικα!!
Σημείωση: Το μήνυμα αυτό γράφτηκε 15 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Dias
Επιφανές μέλος


Ευχαριστώ αλλά θα ηθελα από κάποιον της Γ λυκείου πιο περιεκτική απάντηση.εμενα ο καθηγητης μου εχει πει πως χρειαζονται λιγα πραγματα...βσκ περισσοτερο οι εννοιεσ απο την χημικη ισορροπια και τν οξειδοαναγωγη...τιποτα περισσοτερο...
(Η άσκηση που έβαλες είναι ύλη Β ή Γ? Because I don't understand Christe).
 Απορία για ύλη χημείας για όσους είναι Γ θετική ή Γ τεχνολογική 1:
Απορία για ύλη χημείας για όσους είναι Γ θετική ή Γ τεχνολογική 1:Οι γνώσεις οξειδαναγωγής της Β λυκείου χρειάζονται για τη χημεία της Γ? Σε ποιο κεφάλαιο και σε ποιο βαθμό? (Για την ηλεκτρόλυση να φανταστώ ότι όχι?)


Σημείωση: Το μήνυμα αυτό γράφτηκε 15 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.


Σημείωση: Το μήνυμα αυτό γράφτηκε 15 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
jimmy007
Εκκολαπτόμενο μέλος


γεια σασ 8α ηθελα να με βοηθησετε σε μια ασκηση και ειδικα στην αρχικη αντιδραση επειδη εχω κολλησει,λοιπον...αλκυλοχλωριδιο Α αντιδρα με υδατικο δ/μα Ag2O και σχηματιζει την οργανικη ενωση Β.το αλκυλοχλωριδιο Α αντιδρα επισης με το αλας Να ενος οξεος, οποτε σχηματιζεται αιθανικος ισοπροπυλεστερας. Να βρεθουν οι συντακτικοι τυποι των ενωσεων Α και Β....ευχαριστω πρωκαταλιβολικα!!
Εφόσον σχηματίζει τον αιθανικό ισοπροπυλεστέρα, το αλκυλοχλωρίδιο είναι το 2-χλωροπροπάνιο. Άρα έχει συντακτικό τύπο CH3CHClCH3. Τώρα αντίδραση με Ag δεν θυμάμαι κάποια. Μπορεί βέβαια να μου διαφεύγει αυτή την στιγμή...

Σημείωση: Το μήνυμα αυτό γράφτηκε 15 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
g!orgos
Εκκολαπτόμενο μέλος


 )
)Σημείωση: Το μήνυμα αυτό γράφτηκε 15 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
billpap
Νεοφερμένο μέλος


Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
fockos
Επιφανές μέλος


Ευχαριστώ αλλά θα ηθελα από κάποιον της Γ λυκείου πιο περιεκτική απάντηση.
(Η άσκηση που έβαλες είναι ύλη Β ή Γ? Because I don't understand Christe).
Απορία για ύλη χημείας για όσους είναι Γ θετική ή Γ τεχνολογική 1:
Οι γνώσεις οξειδαναγωγής της Β λυκείου χρειάζονται για τη χημεία της Γ? Σε ποιο κεφάλαιο και σε ποιο βαθμό? (Για την ηλεκτρόλυση να φανταστώ ότι όχι?)

επειδή είδα την ύλη τη ΄γ λυκείου και είδα ότι αλλάξανε την ύλη από τον καιρό το δικό μου (εμείς δίναμε μόνο οργανική και ανόργανη στην β) έχουν μεταφέρει ένα μέρες της ύλης ΄β λυκείου στην ΄γ. Συνεπώς πρέπει να ξέρεις να κάνεις οξειδοαναγωγικές αντιδράσεις. Δεν πρόκειται να σε ρωτήσουν θεωρία απλώς να κάνεις αντιδράσεις και να βάζεις συντελεστές (γιατί μπορούν να βάλουν και ένα θέμα που να απαιτεί να συμπληρώσεις μια τέτοια αντίδρασεις) φυσικά θα είναι τραβηγμένο αν το βάλουν αλλά θεωρητικά μπορεί να βάλουν.
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
strsismos88
Νεοφερμένο μέλος


Υδατ. διαλυμα H2SO4 εχει συγκεντρωση 0,5Μ. Να υπολογισετε τις συγκεντρωσεις ολων των ιοντων στο διαλυμα. Δινεται οτι το H2SO4 ιοντιζεται πληρως στο πρωτο σταδιο, ενω στο 2ο στοδιο ειναι Κα2= 1,25 * 10^-2.
Η λυση δινει [SO4^-2] = 0,0125M, [HSO4^-1] ~ 0,5M, [H3O^+1] ~ 0,5M.
Αυτο που με αφορα περισσοτερο ειναι η [SO4^-2], που δε μου βγαινει αυτοματα 0,0125.
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Chemwizard
Τιμώμενο Μέλος


Θα σε γελάσω και δεν το θέλωΘα ρωτήσω το χημικό μου και αν έχει κάτι κατά νου θα το ποστάρω..!

Σας παραθ'ετω τι λέει η Γενική Χημεία Ebbing/Gammon:
Εφόσον σχηματίζει τον αιθανικό ισοπροπυλεστέρα, το αλκυλοχλωρίδιο είναι το 2-χλωροπροπάνιο. Άρα έχει συντακτικό τύπο CH3CHClCH3. Τώρα αντίδραση με Ag δεν θυμάμαι κάποια. Μπορεί βέβαια να μου διαφεύγει αυτή την στιγμή...
To AgCl (σε νερο κι οχι αμμωνια)ειναι δυσδιαλυτο.Πραγμα που έχω πει πως ευνοεί αντιδρασεις με αυτο το προιόν.οπότε προσανατολήσου προς τα εκει.την αντιδραση δεν την εχω κανει,αλλα 2-χλωρο-προπανιο να αντιδρα με Ag2O...χμ...μου μυριζει 2-xloropropanio(dio tetoia)+Ag20--->2διμεθυλεστερας(X2)+2AgCl+H2O ??? (λογικό ακούγεται)
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
strsismos88
Νεοφερμένο μέλος


Ολα τα διαλυματα εχουν θερμοκρασια 25°C.
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
forakos
Νεοφερμένο μέλος


Καταρχην βρίσκεις την συκεντρωση του δ/τος HCl που ειναι ιση με την [H3O] στο δ/μα γιατι ειναι ισχυρο.Αρα ειναι 0,1 η συγκεντρωση.Μηπως μπορει καποιος να βοηθησει? Υδατικο διαλυμα αλατος NaA 0,1M εχει pH = 9 (Δ1). Υπολογισα Ka(HA) = 10^-5 (ζητειται στο α ερωτημα). Σε 200ml του Δ1 προσθετουμε ορισμενο ογκο διαλυματος HCl που εχει pH = 1, οποτε προκυπτει διαλυμα Δ2 που εχει pH = 2. Να υπολογιστει ο ογκος του διαλυματος HCl.
Ολα τα διαλυματα εχουν θερμοκρασια 25°C.
Γινεται αντιδραση: NaA + HCl --> HA + NaCl
Ta mols του ΝaA ειναι n=CV=0,02
και του HCl είναι 0,1V
ΜΕ διερευνυση βρισκεις οτι σε περισσεια ειναι το HCl και στο τελικο δ/μα έχεις [ΗCl]=
Αρα στο τελικο δ/μα εχεις
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
strsismos88
Νεοφερμένο μέλος


Ευχαριστω!!Καταρχην βρίσκεις την συκεντρωση του δ/τος HCl που ειναι ιση με την [H3O] στο δ/μα γιατι ειναι ισχυρο.Αρα ειναι 0,1 η συγκεντρωση.
Γινεται αντιδραση: NaA + HCl --> HA + NaCl
Ta mols του ΝaA ειναι n=CV=0,02
και του HCl είναι 0,1V
ΜΕ διερευνυση βρισκεις οτι σε περισσεια ειναι το HCl και στο τελικο δ/μα έχεις [ΗCl]=και [ΗΑ]=
Αρα στο τελικο δ/μα εχεις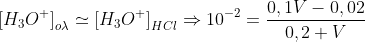
Καμια ιδεα για αυτη την ασκηση υπαρχει? Υδατικο διαλυμα ασθενους οξεος ΗΑ 0,5Μ εχει pH = 2 (Δ1), ενω υδατικο διαλυμα ισχυρης βασης εχει pH = 13 (Δ2). Να υπολογισετε με ποια αναλογια ογκων πρεπει να αναμιξουμε τα διαλυματα Δ1 και Δ2, ωστε να προκυψει διαλυμα Δ3 με pH = 4. Ολα τα διαλυματα εχουν θερμοκρασια 25°C.
Υπολογισα Κα(ΗΑ) = 2*10^-4.
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Chemwizard
Τιμώμενο Μέλος


Ευχαριστω!!
Καμια ιδεα για αυτη την ασκηση υπαρχει? Υδατικο διαλυμα ασθενους οξεος ΗΑ 0,5Μ εχει pH = 2 (Δ1), ενω υδατικο διαλυμα ισχυρης βασης εχει pH = 13 (Δ2). Να υπολογισετε με ποια αναλογια ογκων πρεπει να αναμιξουμε τα διαλυματα Δ1 και Δ2, ωστε να προκυψει διαλυμα Δ3 με pH = 4. Ολα τα διαλυματα εχουν θερμοκρασια 25°C.
Υπολογισα Κα(ΗΑ) = 2*10^-4.
ανεβάζω ενα συνημενο δεν ξερω...φαίνεται?
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
strsismos88
Νεοφερμένο μέλος


Ευχαριστω που ασχοληθηκες φιλε, αλλα καπου κανεις λαθος. Στη λυση βγαινει V1:V2 = 3:10. Γραφει επισης (στη λυση) οτι η αντιδραση που πραγματοποιειται ειναι: HA + OH- --> A- + H3O+. Μετα λεει, ειναι n(HA) = 0,5V1 mol και n(OH-) = 0,1V2 mol. Και τελικα V1:V2 = 3:10ανεβάζω ενα συνημενο δεν ξερω...φαίνεται?
Προσωπικα δε βγαζω νοημα απο τη λυση. Αυτη η ασκηση ειναι στο βοηθημα του Σαββαλα ακριβως πριν το κεφαλαιο των ρυθμιστικων, στην εκδοση μου η τελευταια.
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Chemwizard
Τιμώμενο Μέλος


Ευχαριστω που ασχοληθηκες φιλε, αλλα καπου κανεις λαθος. Στη λυση βγαινει V1:V2 = 3:10. Γραφει επισης (στη λυση) οτι η αντιδραση που πραγματοποιειται ειναι: HA + OH- --> A- + H3O+. Μετα λεει, ειναι n(HA) = 0,5V1 mol και n(OH-) = 0,1V2 mol. Και τελικα V1:V2 = 3:10
Προσωπικα δε βγαζω νοημα απο τη λυση. Αυτη η ασκηση ειναι στο βοηθημα του Σαββαλα ακριβως πριν το κεφαλαιο των ρυθμιστικων, στην εκδοση μου η τελευταια.
βασικα V1 και V2 για αυτον ειναι ο,το το χ και ψ για μενα δεν κολλαμε εκει...το 0,1 ειναι ειπαμε επειδη η βάση ειναι ισχρη με ρΗ 13 απο κει και περα ομως πως δουλευει...?αντιδρα η βαση του στο διαλυμα της πριν τα αναμιξει η εχει το νερο και τα προσθετει...?κι εστω οτι αντιδρα πρωτα η βαση που εγω εβαλα Β- και διισταται πληρως σε ΟΗ- αφου ειναι ισχυρη...το ΗΑ αφου ειναι ασθενες μασ δινει το δικαιωμα να πιστευουμε πως και ι Α- μπορει να αντιδρα με το νερο,αυτο δεν καταλαβαινω.ασ πουμε δηλαδη πως η ισχυρη βαση ειναι ΝαΟΗ,γινεται ολη ΟΗ- και το ασθενες οξυ τυχαια λεω CH3COOH tote kai η A- dld i CH3COO- θα αντιδρα...και παλι επρεπε να βγαινει κανε το πινακακι που εκανα και στην αντιδραση αφαιρεσe τα 0,1V2 mole.Το οξυ ειναι σε περισσεια γιατι εχεισ οξινο ρΗ με ισχυρη βαση.μετα παρε CH3O+=riza KaXcοξεος το Cοξεος ομως ισουται με το C bashs που εφυγε,εχεις και την Κα του HA,kai ti Coksonion apo to pH = 4 ti sto kalo ola ta heis ?
 tha tin psakso otan vro hrono sou to iposxomai.
tha tin psakso otan vro hrono sou to iposxomai.Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
strsismos88
Νεοφερμένο μέλος


Καλα δε πιστευω να πεσει η ιδια στις εξετασεις, αλλα απο την αλλη αν δε μαθω θα σκασω. Παντως προχωρησα στην υλη, ηταν και η μοναδικη ως τωρα που αφησα αλυτη.βασικα V1 και V2 για αυτον ειναι ο,το το χ και ψ για μενα δεν κολλαμε εκει...το 0,1 ειναι ειπαμε επειδη η βάση ειναι ισχρη με ρΗ 13 απο κει και περα ομως πως δουλευει...?αντιδρα η βαση του στο διαλυμα της πριν τα αναμιξει η εχει το νερο και τα προσθετει...?κι εστω οτι αντιδρα πρωτα η βαση που εγω εβαλα Β- και διισταται πληρως σε ΟΗ- αφου ειναι ισχυρη...το ΗΑ αφου ειναι ασθενες μασ δινει το δικαιωμα να πιστευουμε πως και ι Α- μπορει να αντιδρα με το νερο,αυτο δεν καταλαβαινω.ασ πουμε δηλαδη πως η ισχυρη βαση ειναι ΝαΟΗ,γινεται ολη ΟΗ- και το ασθενες οξυ τυχαια λεω CH3COOH tote kai η A- dld i CH3COO- θα αντιδρα...και παλι επρεπε να βγαινει κανε το πινακακι που εκανα και στην αντιδραση αφαιρεσe τα 0,1V2 mole.Το οξυ ειναι σε περισσεια γιατι εχεισ οξινο ρΗ με ισχυρη βαση.μετα παρε CH3O+=riza KaXcοξεος το Cοξεος ομως ισουται με το C bashs που εφυγε,εχεις και την Κα του HA,kai ti Coksonion apo to pH = 4 ti sto kalo ola ta heis ?tha tin psakso otan vro hrono sou to iposxomai.
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Chemwizard
Τιμώμενο Μέλος


Ακριβώς.Ο Pauli λεει:ΑΠΑΓΟΡΕΥΕΤΑΙ σε ενα ατομο,δυο ηλεκτρόνια να εχουν 4 κβαντικους αριθμους ισους.Είπα λαλακία... Τα μονήρη είναι που αφορούν τον Hund.
Δηλαδή αν εχουν τους τρείς(στιβαδα-υποστιβάδαm-τροχιακό,ο ms που καθοριζει το spin θα ειναι de facto διαφορετικος.)
Αυτο εξυπακουεται οτι ενα τροχιακο χωραει το πολύ δυο ηλεκτρονια (υπαρχουν δυο δυνατοι ms +/- 1/2)
Ο Pauli ρησιμοποιείται ΣΥΝΗΘΩΣ (οχι παντα) σε περιπτωσεις ηλεκτρονιων ιδιου τροχιακού.Αν δηλαδη δεις κάτι της μορφής (^^)-σκεψου το σαν βελακια-παραβιαζεται ο pauli.
O Ηund αφορα εναν ευρύτερο αριθμό ηλεκτρονίων,σε στοιβαδες με περισσοτερα των 1 τροχιακών,κοινως εκτος της s. στη στιβαδα p πχ,αν δεις κατι της μορφης (^)(^)(ν) παραβιαζεται ο Ηund,του οποιου ή αρχη λέει:Σε υμισυμπληρωμενες στιβαδες,τα ηλεκτρονια διατασσονται στα τροχιακα αυτών,ετσι ωστε να έχουν τη μεγιστη απολυτη τιμη αθροίσματος spin.(δηλαδη αν εχεις 3 ηλεκτρονια πχ στην p ή 3/2 ή -3/2,ενώ δυο e- με αντιθετο spin μας δινουν 0 στο σύνολο,οποτε τοτε προκυπτει 1/2 και απορριπτεται.)
Σημείωση: Το μήνυμα αυτό γράφτηκε 14 χρόνια πριν. Ο συντάκτης του πιθανόν να έχει αλλάξει απόψεις έκτοτε.
Χρήστες Βρείτε παρόμοια
-
Τα παρακάτω 0 μέλη και 1 επισκέπτες διαβάζουν μαζί με εσάς αυτό το θέμα:Tα παρακάτω 330 μέλη διάβασαν αυτό το θέμα:
- nikolina
- jellojina
- Panatha mono
- trifasikodiavasma
- Reader
- lyfestyle.123
- BatGuin
- Nala
- suaimhneas
- Than003
- Μήτσος10
- georgetherrr
- Macyk
- petrosmallios
- haji
- panosT436
- Corfu kitty
- Joji
- Hased Babis
- Qwerty 0
- soleilst
- ioanna2007
- tan07
- giorgis_1996
- Scandal
- Maynard
- bboys
- sophiaa
- sofia07
- AggelikiGr
- mvas
- fgk
- ch2006
- pnf292
- Magdap
- Enhypen
- Lia 2006
- thepigod762
- marikakitsou16
- Unboxholics
- MrDna
- Kate1914
- despoina13
- Αντωνία
- iiTzArismaltor_
- Albert.123
- bibliofagos
- mirara
- tomftw
- Magigi
- Debugging_Demon
- Greg25
- Bobaros32
- OChemist
- peter347
- kost28
- Startx0
- marina.marina
- kiyoshi
- nimbus
- Isa
- gzois
- MR WHITE
- TheNorth
- Γιώργος μεγ
- BiteTheDust
- zodiacrube
- carnage
- phleidhs
- Lifelong Learner
- Γιωργος15773
- tsiobieman
- Sofos Gerontas
- Marel
- xrisamikol
- bill09876
- fockos
- AnnaRd
- Ilovemycats27
- Obi-Wan Kenobi
- arko
- Marianna.diamanti
- spring day
- Neiromai
- brouss
- evaggelia anna
- Abiogenesis
- Jojo K
- Helen06
- P.Dam.
- Marcos.Kis
- eukleidhs1821
- Quincy
- arapakos
- Maria_Xagorari
- penelopenick
- BillyTheKid
- Physicsstudent
- mitskification
- Mariamar
- denjerwtithelwhelp
- Alexecon1991
- augustine
- synthnightingale
- just some guy
- gamer05
- Praxis
- Deneimaikala
- Olakalamallon
- xristosgkm
- katia.m
- user-2
- elenitren
- μια φασαια
- το κοριτσι του μαη
- Final4
- Stavros o Arkas
- shezza94
- koukdespoina2004
- userx
- Otinannai
- Nick_nt
- Wonderkid
- Vasso1983
- maril8na
- GeorgePap2003
- Liverpoolenjoyer
- Sherlockina
- denpap1985
- Chemwizard
- Nikoleta_Giann
- george777
- poioseinia
- T C
- Theodora03
- marioushi
- menual
- Pharmacist01
- lepipini
- PanosBat
- ioanna06
- ggl
- rempelos42
- Jamie
- desp1naa
- makara
- Specon
- Apocalypse
- walterrwhite
- Nic Papalitsas
- Ameliak
- Manuela98
- ένας τυχαίος
- SoyN
- nucomer
- J.Cameron
- constansn
- De Broglie
- ismember
- v_marm
- angies
- Steliosgkougkou
- Deadly_sorrowX
- bruh_234
- Dr. Gl. Luminous
- the purge
- giannhs2001
- Kitana
- Applepie
- Fagia ツ
- eirinipap
- oups
- Georgek7
- mpapa
- estrela
- Nefeloula
- margik
- George.S
- George_dr
- anakiriak@yahoo
- Ioanna98
- Marple
- tapeinoxamomilaki
- arisgiap
- persi
- F1L1PAS
- roud
- Corn90
- theodoraooo
- Meow
- alpha.kappa
- Athens2002
- Ryuzaki
- Miranda32
- ougka pougka
- mikriarchitectonissa
- emilyfan85
- Nikoletaant
- EleniStella
- JST
- Johanna Mark
- Anonymous0
- Phys39
- Eirinakiii8
- Annou1
- Mammy Nun
- neurogirl
- alexgiann
- Medjnik
- Appolon
- jYanniss
- Superhuman
- papa2g
- QWERTY23
- SlimShady
- xakounaamatata
- dimitris20
- Devilshjoker
- GTS
- Zoigian
- leonnnn
- mara__
- igeorgeoikonomo
- panosveki
- Sense
- charmander
- Jimmis18
- Dimitris9
- Georgekk
- Nia Skg
- anixia
- vetas
- pepsoula
- Anxious
- fujiko
- Nefh_
- Alexandros973
- Alexandros36k
- chochoru
- Κορώνα
- AnAnxiousStudent
- xriiistiiinaaa
- jimnikol21
- xristina11
- StavMed
- EiriniS20
- Χαρουλιτα
-
Φορτώνει...
-
Το forum μας χρησιμοποιεί cookies για να βελτιστοποιήσει την εμπειρία σας.
Συνεχίζοντας την περιήγησή σας, συναινείτε στη χρήση cookies στον περιηγητή σας.
 Αρχική Forum
Αρχική Forum
 Ρωτήστε κάτι
Ρωτήστε κάτι
 Προσωπικές Συζητήσεις
Προσωπικές Συζητήσεις
 Πανελλαδικές
Πανελλαδικές
 Αγγελίες
Αγγελίες
 Συνδεδεμένοι Χρήστες
Συνδεδεμένοι Χρήστες
 Λίστα Αποκλεισμένων
Λίστα Αποκλεισμένων
 Υπεύθυνοι του Forum
Υπεύθυνοι του Forum
 e-steki
e-steki

